Метанирование оксида углерода. Кинетика
Литературные данные по кинетике метанирования довольно противоречивы. Это, вероятно, определяется тем, что данные, полученные для целей проектирования, большей частью основывались на формальной кинетике. Корректное определение микрокинетических показателей осложняется прежде всего тем, что при такой сильно экзотермической реакции, как метанирование, необходимо учитывать не только наличие стадий инициирования реакции и «закалки», но и медленное изменение концентраций и температуры в слое катализатора из-за его дезактивирования за счет отравления и старения. Так что далее, по существу, следует только перечислить кинетические уравнения, установленные за период 1946— 70 гг. [12, 13].
![]()
Для побочного образования СО2 можно в этом случае записать такое кинетическое уравнение:
![]()
Если исходят чисто формально из стехиометрического брутто равенства (3), получают [15]:
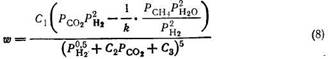
Произвольный выбор такого уравнения, называемого уравнением Хоугена — Ватсона, может показаться лишенным смысла для химиков, специализирующихся в изучении механизма каталитических реакций. Однако это уравнение представляет собой математическую модель, которая особенно пригодна для аппроксимирования очень большого числа переменных на ЭВМ в связи с необходимостью оценки значительного числа констант.
При одновременной адсорбции оксида углерода и водорода на катализаторах — металлах VIII группы Лэнгмюровская изотерма адсорбции смеси не выполняется [16], поэтому выведение уравнения Хоугена — Ватсона во много раз усложняется, и вместо этого пользуются простыми математическими выражениями типа уравнения Лэнгмюра, в которых показатели степени устанавливают эмпирически, например:
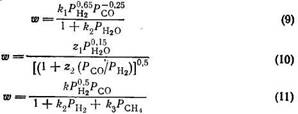
При выводе уравнения (9) условия таковы [17]: 270—290 С, катализатор Ni + MgO, энергия активации 86,3 кДж/моль. Для уравнения (10) условия иные [18]: 200—300°С, 0,2—1,4 МПа, никелевый катализатор.
При осуществлении метанирования на стационарном борникелевом катализаторе справедливо уравнение [19]:
![]()
Положительный порядок реакции по СО можно ожидать, если работают [20] при малых концентрациях СО, например, при очистке газа для синтеза аммиака (5000—9000 млн-1 СО):
![]()
Парциальное давление избыточного водорода вошло в константу скорости k.
Кинетику метанирования определяли [21] и в пустотелой колонне с тонкоизмельченным Ni—MgO-катализатором без носителя, суспендированным в высококипящих углеводородах, при давлении до 1 МПа [21]. Концентрация катализатора была небольшой, а скорость газа выбрана высокой, так что самой медленной ступенью являлась химическая реакция. Упрощенное кинетическое уравнение метанирования в жидкой фазе
![]()
оказалось пригодным для оптимизации расчетов, подтвержденных [22, 23] экспериментально.