Сравнение опытов по алкилированию бензола и изомеризации фенилалканов
Из сравнения опытов по алкилированию бензола и изомеризации фенилалканов на галогенидах алюминия видно, что изомеризация протекает в существенно более жестких условиях, чем алкилирование. Так, если алкилирование в присутствии хлорида и бромида алюминия гладко идет при 5—30 °С в течение 10—45 мин, то для достижения равновесия при изомеризации требуется время контакта 180 мин при 80°С.
Изучая алкилирование бензола 1-октеном в присутствии хлорида алюминия, также установлено, что в продуктах реакции присутствуют все возможные позиционные изомеры вторичных алкилбензолов [219]. Анализ непревращенных олефинов показал в то же время, что в них преобладает 1-октен, и по своему изомерному составу они не соответствуют изомерному составу получающейся смеси вторичных алкилбензолов.
Казалось бы, что эти данные соответствуют представлениям, развиваемым в работах [216, 218]. Однако, авторы работы [219] попытались оценить скорость изомеризации фенилалканов в условиях, соответствующих условиям проведения реакции алкилирования. Изомеризации чистых фенилалканов при этом не наблюдалось. Образование изомерных фенилалканов не было зафиксировано и в том случае, когда реакция проводилась в среде бензола. Это свидетельствует о том, что изомеризацию нельзя объяснить и межмолекулярным переносом алкильных групп. Поэтому авторы этой работы полагают, что в присутствии хлорида алюминия, так же, как и в присутствии протонных кислот, изомеризация олефинов предшествует алкилированию, протекая на стадии образования карбкатиона:
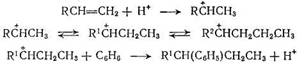
Такое представление о механизме образования изомерных фенилалканов является в настоящее время общепризнанным, хотя в этом случае трудно объяснить несоответствие изомерного состава непревращенных олефинов изомерному составу фенилалканов, особенно, если считать, что лимитирующей стадией процесса алкилирования является образование ароматического σ-комплекса.
Отметим, что по мнению авторов [219] лимитирующей стадией процесса является образование алкилкатиона. Этим они, кстати, объясняют различие реакционной способности внутренних и α-олефинов. По их данным, при алкилировании бензола α-олефинами, регулируя состав катализатора, можно добиться изменения соотношения выходов изомерных фенилалканов. Авторы сопоставили активность в реакции алкилирования алюмоорганических соединений — триалкилов алюминия, диалкилалюминийхлоридов и алюминийалкилдихлоридов.
Согласно полученным данным активными являются лишь алкилалюминийдихлориды. Они обладают более мягким, чем хлорид алюминия, каталитическим действием и позволяют получать продукт с повышенным содержанием 2-фенилалканов.
Опубликованные в последнее время данные по кинетике алкилирования бензола высшими олефинами на хлориде алюминия являются крайне противоречивыми.