Реакции изомеризации шестичленных нафтенов
При изомеризации на бифункциональных металлических катализаторах, в том числе на платиновых, шестичленные нафтены могут подвергаться следующим превращениям [28]:
1) изомеризации шестичленного цикла в пятичленный

2) перемещению алкильных заместителей в кольце
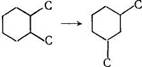
3) изменению числа алкильных заместителей в цикле
![]()
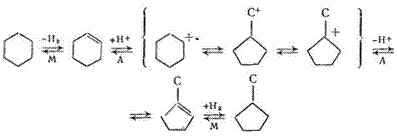
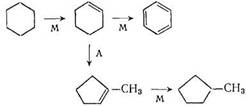
Реакции изомеризации нафтенов протекают по карбкатионному механизму [23]. Промежуточный продукт реакции —циклоолефин, образующийся в результате дегидрирования нафтена на металлическом участке катализатора. Циклоолефин мигрирует на кислотный участок носителя, где превращается в карбкатион. Реакции карбкатиона ведут к образованию изомерного циклоолефина, в результате гидрирования которого на металлическом участке получается углеводород, изомерный исходному. Так, схему изомеризации циклогексана в метилциклопентан можно представить следующим образом (М —металлические участки катализатора, А —кислотные):
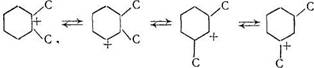
Третичный карбкатион наиболее устойчив и не всегда способен к перегруппировкам. Поэтому протеканию перегруппировок может способствовать образование менее устойчивого, но более реакционно-способного вторичного карбкатиона [2]. Исходя из этого, перемещение алкильных заместителей в кольце циклогексана можно представить в следующем виде:
Реакции типа (1) и (2) протекают значительно легче, чем реакции (3), ведущие к увеличению числа алкильных заместителей в цикле. Так, скорость изомеризации этилциклогексана меньше по сравнению со скоростью изомеризации других шестичленных нафтенов состава С8 [28]. Косвенным подтверждением служат результаты, полученные при каталитическом риформинге бензиновой фракции, состоящей из углеводородов С8 и обогащенной этилциклогексаном [29]. Относительные количества ксилолов в катализате отвечали равновесию. Что же касается этилбензола, то выход его соответствовал содержанию этилциклогексана в сырье и намного превышал равновесное содержание в смеси ароматических углеводородов состава С8.
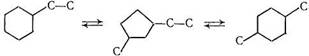
Предложена схема изомеризации этилциклогексана в диметилциклогексаны, в соответствии с которой циклопентановые углеводороды являются промежуточными продуктами реакции [28]:
В работе [30] были изучены превращения метилциклогексана на платиновом катализаторе в условиях, при которых углеводород подвергался как изомеризации, так и дегидрированию (452 °С, 4,9 МПа, подача углеводорода 2 ч-1 отношение водород : углеводород = 6,6). Выход, в моль (на 100 моль метилциклогексана) составил:
Углеводороды С1-С6 | 6 |
Алкилциклопентаны (1,1-, 1,2- и 1,3-диметилциклопентаны+ этилциклопентан) | 31 |
Метилциклогексан (непревращенный) | 6 |
Толуол | 56 |
Другие углеводороды | 1 |
Таким образом, количество алкилциклопентанов в продуктах реакции в 5 раз превышало количество метилциклогексана.
Равновесие для реакции изомеризации циклогексана при 460— 500 °С целиком сдвинуто в сторону метилциклопентана (содержание его в равновесной смеси с циклогексаном 93—94%) [31 ]. С другой стороны, при этих же температурах и парциальном давлении водорода до 2 МПа (см. рис. 1.1) равновесие для реакции дегидрирования циклогексана также сильно смещено в сторону бензола. В этих условиях избирательность превращения циклогексана и других шестичленных нафтенов предопределяется относительными скоростями их дегидрирования и изомеризации. В соответствии с изложенным выше механизмом этих реакций, схему превращения циклогексана в бензол и метилциклопентан можно представить в следующем виде:
При чрезмерной кислотности катализатора скорости образования бензола и метилциклопентана становятся соизмеримыми, что должно привести к снижению селективности ароматизации циклогексана. Иллюстрацией подобного эффекта могут служить данные, полученные при каталитическом риформинге смеси этилциклогексана и диметилциклогексанов на двух типах платиновых катализаторов (495 °С, 2МПа) [20]:
| Степень превращения, % | Селективность ароматизации, % |
Стандартный катализатор риформинга | 97 | 97 |
Катализатор с высокой кислотностью | 94 | 65 |
При близкой степени превращения сырья селективность его ароматизации оказалась значительно ниже при осуществлении процесса на платиновом катализаторе с высоким уровнем кислотности.'
Обычно скорость ароматизации циклогексана значительно больше скорости его изомеризации на алюмоплатиновом катализаторе [32]. Потаповой и Маслянским были, измерены относительные скорости этих реакций на катализаторе типа АП-56. Скорость образования бензола приблизительно на два порядка больше скорости образования метилциклопентана, если реакцию проводить при 490 °С и рН2 2 МПа.
Исходя из относительных скоростей дегидрирования и изомеризации циклогексана можно было ожидать, что наибольшая селективность его превращения в бензол будет достигнута при больших объемных скоростях пропускания углеводорода. Так, в той же работе было показано, что при увеличении объемной скорости подачи циклогексана (v) содержание метилциклопентана (МЦПа) в катализате снижается, а содержание бензола (Б) растет.
Ниже показано влияние объемной скорости на молярное содержание углеводородов в катализате (490 °С, 2МПа), в %:
v, ч-1 | МЦПа | ЦГа | Б |
1,9 | 11,0 | 2,5 | 86,5 |
3,0 | 8,4 | 2,4 | 89,0 |
8,0 | 3,2 | 1,4 | 95,4 |
В промышленных условиях в первом по ходу сырья реакторе обычно поддерживают объемную скорость подачи сырья в пределах 10—15 ч-1 что способствует селективному превращению шестичленных нафтенов в ароматические углеводороды.