Превращения важнейших функциональных и гетеросоединений
Сложноэфирные группы могут расщепляться по трем следующим связям:
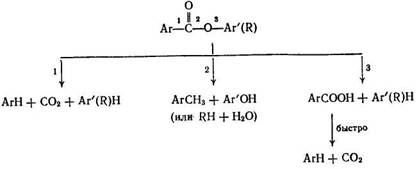
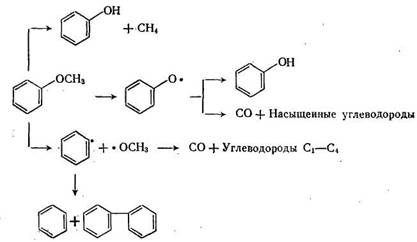
Опыты с модельными веществами, проведенные в условиях деструктивной гидрогенизации (485°С, ≈ 30 МПа, катализатор Fe), показали [9], что путь 3 наименее вероятен, путь 1 преобладает в случае этерификации эфирной группы спиртом (заместитель R), путь 2—в случае этерификации фенолом (заместитель Ar). Процесс протекает через гомолитическое расщепление связей и промежуточное образование радикалов, что доказывается образованием соединений Ar—Ar, Ar—Ar' и Ar—R. Образование фенолов, оксидов углерода и воды отмечалось также в недавней публикации [19] по изучению кинетики элиминирования кислородсодержащих групп в ходе гидрогенизации бурого угля. Порядок легкости удаления: карбоксильные, карбонильные и эфирные группы.
Простые эфиры, если они образованы арильным и алкиль-ным радикалом, превращаются очень быстро, тогда как арилари-ловые эфиры относительно стабильны. В молекуле простого эфира связи Ar—О и О—R (алкил) неравноценны, так как первая упрочнена за счет п, р-сопряжения. Поэтому соотношение разрывов связей 1 и 2 (Ar—О—R) изменяется в ряду: анизол — фенетол — н-пропилфениловый эфир — трег-бутилфениловый эфир примерно от 1 : 1 до 1 : 100 [19].
Детальный анализ продуктов деструкции анизола, меченного 14С в кольце (в положении 1) и в метильной группе, показал, что процесс протекает по радикальному механизму; доказательством этого является образование метилциклогексана, толуола, крезолов, дифенила [19]. Промежуточно образуемые оксифенильные и окси-метильные радикалы интенсивно подвергаются вторичным превращениям, в том числе разложению с образованием СО, который содержит 14С в обоих случаях. Из анизола образуется 4,3% насыщенных углеводородов С5—С7, в то время как из фенола только доли процента. Это также доказывает, что промежуточным продуктом является не фенол, а оксифенильный радикал:
|
Спирты и карбонильные соединения менее харак-. терны для угольных продуктов и поэтому привлекли меньшее внимание. Они тоже очень быстро восстанавливаются [21], занимая промежуточное положение в ряду других кислородных соединений:
Сложные эфиры > Кетоиы > Простые эфиры > Спирты > Фенолы
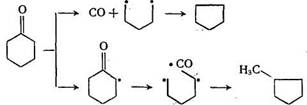
Их превращения также протекают по радикальному механизму в условиях деструктивной гидрогенизации (485 °С, ≈30 МПа, катализатор Fe на полукоксе), что видно, например, из сопоставления выходов продуктов из циклогексанона и циклогексана [5]: непревращенный циклогексан 17,1 и 86%, метилциклопентан 17,6 и 30%, циклопентан 8,4 и 0%. Следовательно, неправильно думать, что процесс идет по схеме
![]()
а более вероятен радикальный механизм, например:
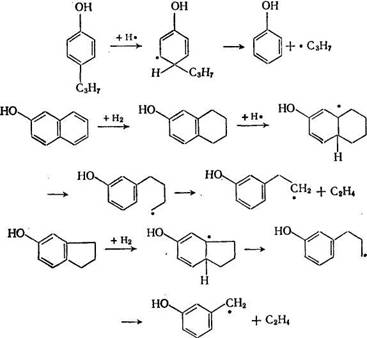
Превращения фенолов представляют наибольший интерес, так как соединения фенольного характера содержатся в продуктах ожижения угля, а получение ценных низших фенолов заманчиво с экономической точки зрения. В условиях деструктивной гидрогенизации фенолы подвергаются восстановлению с элиминированием гидроксила и деструкции, ведущим к образованию кислотных продуктов меньшей молекулярной массы. Первые резко преоб-ладают в случае полициклических фенолов (нафтолы, фе-нилфенол), а в случае алкилфенолов довольно заметна доля вторых (табл. 76).
Из данных табл. 76 видно, что наряду с деструкцией идет изомеризация (метилинданолы из тетрагидро-β-нафтола, изопро-пилфенол из н-пропилфенола, инданол-4 из инданола-5). Характерно, что в случае н-пропилфенола, тимола и п-бензилфенола преобладает разрыв а-связи, в случае инданола-5 разрыв β-связи.
Таблица 76. Продукты гидрогенизации некоторых фенолов [22]
Продукт гидрогенизации | Содержание продуктов, % (масс.) | ||||||
н-пропил-фенол | тимол | п-бензил-фенол | а-наф- тол | β-наф-тол | тетрагидро-3-наф-тол | инданол-5 | |
Фенол | 15,9 | 11,7 | 16,6 | 0,5 |
| 1,5 | 0,9 |
о-Крезол |
|
| — | 0,3 |
|
|
|
м-Крезол |
| 24,7 | — | 0,6 | 0,4 | 2,0 | 6,6 |
п-Крезол | 4,6 | — | — | — | — | 1,0 | 3,8 |
м-Этилфенол | — | — | — | 0,8 | 1,0 | 6,0 | 1,3 |
п-Этилфенол | 8,0 | — | — | — | — | — | 0,8 |
н-Пропилфенолы | — | — | — | — | — | — | 7,5 |
Изопропилфенол | 2,7 | — | — | — |
| — | - |
Бутилфенолы | — | — | — | — |
| 9,4 | - |
-Нафтол | — | — | — | — | — | 1,8 | — |
Инданол-4 | — | — | — | — | — | — | 2,3 |
Метилинданолы |
|
|
|
|
| 5,9 |
|
а в случае нафтолов разрыв γ-связи. Эта особенность также объясняется радикальным механизмом, например:
Азотистые соединения, как указывалось выше, существенно изменяются в ходе деструктивной гидрогенизации: среди них возрастает доля соединений основного характера. Опыты с ин- дивидуальными соединениями раскрывают механизм этого процесса (табл. 77).
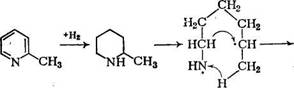
Как видно из таблицы, образование веществ основного характера протекает главным образом за счет упрощения структуры пространственно затрудненных гетероциклов (2-стирилхинолин), а также за счет превращения гетероциклических колец (в том числе слабоосновных пиррольных) в алифатические амины после реакций гидрирования и деструкции. Состав гидрогенизатов азотистых соединений сложен и также объясняется радикальным характером процесса [5]. Например, из а-пиколина образуются небольшие количества циклогексиламина и циклогексана, что указывает на внутримолекулярный перенос водорода в бирадикале:
![]()
Из хинолина и его гомологов образуется значительное количество не только ароматических, но и циклогексановых углеводоро-
Таблица 77. Продукты гидрогенизации некоторых азотистых соединений [23] (460 °С, 23—26 МПа, железный катализатор)
Исходное вещество | Выход, % (масс.) | |||||||
| Жидкий гидрогенизат | Неизменившееся вещество | продукты основного характера * | Нейтральное масло | NH3 | |||
| гидрирование |
Продукты деструкции |
Продукты конденсации |
|
| |||
| в гетеро- циклическое кольцо | в бензольное кольцо |
|
| ||||
а-Пиколин | 89,5 | 44,9 | 1,9 |
| 5,0 | 13,1 | 24,6 | 2,5 |
Хинолин | 98,0 | 7,1 | 32,7 | 5,4 | 22,7 | 20,6 | 9,5 | 0,5 |
1,2,3,4-Тетрагидрохииолин | 86,0 | 9,7 | — | 8,8 | 30,2 | 7,2 | 30,1 | 3,0 |
2-Метилхинолнн | 96,0 | 5,1 | 29,1 | 21,7 | 19,7 | 5,9 | 14,5 | 0,9 |
2-Стирилхинолин | 98,0 | — | 58,0 | 58,0 | 58,0 | 58,0 | 40,0 | 0,5 |
Бензонитрнл | 96,0 | — | 5,0 | 5,0 | 5,0 | 5,0 | 91,0 | 5,1 |
Карбазол | 100,0 | 90,0 | 0,8 | 0,8 | 0,8 | 0,8 | 99,2 | 0,1 |
2-Метилнндол | 91,0 | 22,6 | 7,1 |
| 9,9 | 4,8 | 69,2 |
|
* Экстрагируемые 10%-ной H2SO4.
дов. Для этого нужно было бы предположить либо гидрирование бензольных углеводородов в заметных количествах, либо образование декагидрохинолина из 1,2,3,4-тетрагидрохинолина. И то и другое невероятно в условиях жидкофазного процесса с железным катализатором, а объяснение заключается в изомеризации 1,2,3,4-тетрагидрохинолина в 5,6,7,8-тетрагидрохинолин [23]:
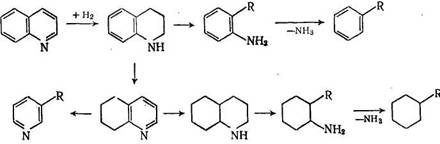
Из-за отмеченной выше неравноценной реакционной способности бензольного и пиридинового кольца хинолина предлагаемая схема имеет, видимо, общий характер.
В недавней работе [24] по изучению механизма денитрации хинолина (катализатор Ni + Мо на Аl2О3, 300—375 °С, 2—14 МПа) отмечалось, что гидрирование пиридинового кольца очень быстро достигает равновесия, в то время как гидрирование бензольного кольца идет относительно медленно. Поэтому главным продуктом реакции является о-пропиланилин, который разлагается далее. Декагидрохинолин образует низшие амины, быстро восстанавливающиеся в углеводороды. Единственное отличие этого механизма от приведенного выше заключается в том, что никель-молибденовый катализатор по сравнению с железным ускоряет раскрытие и циклогексанового кольца, вследствие чего образуются как алифатические амины, так и алифатические углеводороды.