Скорость проникновения водорода через металл
Скорость проникновения водорода через металл с увеличением концентрации сероводорода возрастает и при некоторой концентрации достигает насыщения. Влияние концентрации H2S в газовой фазе на наводороживание СтЗ в 3 %-м растворе NaCl показано на рис. 4.7. Отмечается резкое увеличение доли абсорбируемого сталью водорода при переходе от 1 до 2 % содержания H2S в газовой фазе [8].
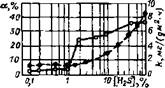
Рис. 4.7. Влияние объемного содержавия H2S в газовой фазе на изменение отношения а объема продиффундировавшего водорода и его общему количеству, выделявшемуся при коррозии (сплошная кривая) и на скорость коррозии k (пунктирная кривая) стали СтЗ в 3%-м растворе NaCI (рН=5) [8]
![Доля а продиффундировавшего в металл водорода от его общего объема, выделияшегося в процессе коррозии сталей в растворах типа дренажных вод с H2S (сплошные кривые) и без H2S (пунктирные кривые) при различных pH [8];1—СтЗ; 2—08X13 Доля а продиффундировавшего в металл водорода от его общего объема, выделияшегося в процессе коррозии сталей в растворах типа дренажных вод с H2S (сплошные кривые) и без H2S (пунктирные кривые) при различных pH [8];1—СтЗ; 2—08X13](http://www.e-him.ru/img/skor-pron-vodorod_clip_image002.jpg)
Рис 4.8. Доля а продиффундировавшего в металл водорода от его общего объема, выделияшегося в процессе коррозии сталей в растворах типа дренажных вод с H2S (сплошные кривые) и без H2S (пунктирные кривые) при различных pH [8];1—СтЗ; 2—08X13
Скорость проникновения водорода в углеродистую сталь снижается с увеличением pH среды. Она резко нарастает в течение первых 2—3 ч, но значительно падает в течение суток. По прошествии 8 суток эта скорость становится весьма низкой и постоянной.
В растворах тина дренажных вод нефтезаводских аппаратов (средний состав, г/л; 10.8 S2-; 2,5 S04-; 0,6 SO3(2-); 0,55 Cl-; Са2+ — следы, Mg2+ — следы) диффузия водорода в углеродистую сталь происходит во всем исследованном диапазоне < pH < 11,5; а в хромистую сталь марки 08X13 до pH < 6 [8]. В этих же растворах, но без сероводорода проникновение водорода в металл происходит только до pH < 4; при pH < 4 обе стали не подвержены наводороживанию (рис. 4.8) [8].
Отмечается экстремальный характер зависимости диффузии от pH (с максимум вблизи pH ~ 4) в сероводородных растворах. Эта зависимость при отсутствии сероводорода имеет линейный характер. Переход от кислых к нейтральным сероводородным растворам сопровождается резким уменьшением количества диффундирующего в металл водорода. Однако при увеличении pH выше 8 наблюдается усиление наводороживания. Повышение температуры, в общем, снижает долю водорода, внедряющегося в металл при стимулировании его абсорбции сероводородом.
Содержание водорода в железе при нормальных условиях чрезвычайно мало, однако оно заметно возрастает с увеличением температуры и парциального давления водорода. При наводороживанни в электролитах в результате катодной реакции на поверхности металла может создаться такая концентрация адсорбированных атомов водорода, которая в отношении эффекта абсорбции эквивалентна давлению газообразного водорода в тысячи атмосфер при очень высоких температурах [41]. Растворимость водорода в стали определяется фугитивностью водорода на поверхности металла. Фугитивность водорода увеличивается с ростом парциального давления H2S. Например, в искусственной морской воде при парциальном давлении H2S 0,1 и 0,0005 МПа фугитивность водорода соответственно составляла 17,6 и 0,78 ГПа [42].
Растворимость водорода в стали определяется особенностями металла и энергетикой химических реакций, вызывающих внедрение водорода в металл и температурой. Химический состав и структура стали влияют на ее чувствительность к воздействию водорода. Все стали с ферритной, ферритно-перлитной, бейнитной и мартенситной структурами могут подвергаться водородному охрупчиванию.
Стали аустенитного класса поглощают на несколько порядков больше водорода, чем стали ферритного и мартенситного классов, тем не менее аустенитные стали в меньшей степени подвержены водородной хрупкости. Основной причиной этого частично считают малый коэффициент диффузии водорода в аустените [18].