Кинетика ЭСК в слабоосновных и нейтральных средах
Кинетику ЭСК в слабоосновных и нейтральных средах [21] связывают с конкурентной адсорбцией HS-, ОН- и Сl-_-ионов и формированием сульфидных пленок. Тормозящее действие пленок определяется EKop pH, анионным составом раствора и гидродинамическим режимом: вращение электрода способствует, а наличие ОН- и Cl- ионов препятствует формированию пленок с защитными свойствами.
Эксперименты [21] с чистым железом в растворах НСlO4 + Na2S показали при pH 1,10 и 2,50 тафелевские зависимости iкор = f(Екор) в широком интервале потенциалов. С увеличением содержания H2S jкор растет при сохранении наклона (рис. 4.4).
![]()
При увеличении pH до 3,0 jкор падает, а введение H2S сопровождается небольшим увеличением jkop при сохранении эквидистантности зависимостей jкор от pH.
Во влажном H2S ЭСК практически не идет при относительной влажности у С 90 %, в интервале 90 < у < 100 % достигает 0,05 г/( м2∙ч) и лишь при у = 100 % составляет 0,10 г/(м2∙ч). Это связано [5, 22] с пленкообразованием; при низкой у газа даже с высоким (10 %) содержанием H2S пленка имеет хорошие защитные свойства. При высокой у пленка разрыхляется и капиллярными силами заполняется агрессивным электролитом. При повышении температуры у падает, и защитные свойства образующихся пленок улучшаются. Поэтому температурная зависимость ЭСК в газе экстремальна (максимум при 40°С).
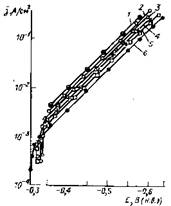
Рис. 4.4. Катодные поляризационные кривые для железа в растворах, содержащих (1—5) и не содержащих (6) H2S
Содержание H2S, Моль/л; 1— 10-2; 2— 10~3; 3— 10-4; 4— 10-5; 5 — 10-6
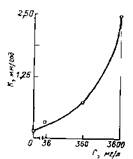
Рис. 4.5. Влияние содержания хлоридов С на скорость коррозии К углеродистой стали в системе Н20—H2S—NaCI [20]
В жидкой фазе ЭСК протекает в 3—10 раз быстрее [21, 22]: ее скорость при росте температуры от 10 до 30 °С увеличивается, медленно, от 30 до 60 °С — быстро, а между 60 и 80 °С— снова медленно.
В растворе (NH4)2S при 25°С скорость ЭСК увеличивается с возрастанием скорости движения среды и содержания хлоридов. В системе H2S—Н20—NaCl рост содержания хлоридов, ведет к экспоненциальному усилению скорости коррозии (рис. 4.5).
Для имитирующих пластовые воды растворов (0—10 % NaCl и Na2S04) с pH, изменяющимся от 4,8 (при 200 мг/л) до 4,0 (при 1500 мг/л H2S) максимальные скорости ЭСК установлены [23] при 1 % NaCl [27]. Максимум объясняется превалирующим влиянием роста электропроводимости среды при низких и конкурентной адсорбцией вытесняющих НS--ионы хлор- ионов при более высоких (>2,5%) содержаниях NaCl.
Практическая неизменность скоростей ЭСК при возрастании концентрации NaCl в сероводород содержащих растворах от 2,5 до 20 % объясняется компенсацией этих эффектов [23]. Стимулирующее влияние хлоридов на анодные и катодные процессы при ЭСК показано на рис. 4.6.
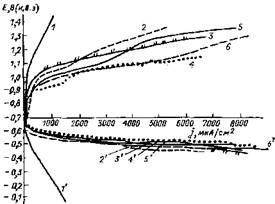
Рис. 4.6. Катодные анодные поляризационные кривые в насыщенных растворах сероводорода с различным содержанием NaCl [28]:
1,1‘— 0; 2,2'—1; 3,3'—3; 4,4' — 5; 5,5'—10; 6,6'—30%