Кинетика электрохимической сероводородной коррозии
Характерная особенность H2S как коррозионного агента — стимулирование обеих сопряженных электродных реакций, создаваемое продуктами диссоциации (Н+, HS-. S2-) и коррозии (сульфиды железа). Этим объясняются тяжелые повреждения стальных конструкций в сероводородных средах. Исследования кинетики ЭСК строятся на оценке обеих электродных реакций в конкретных условиях.
В водных сульфидных растворах возможны пять катодных реакций:
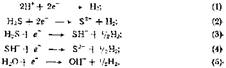
Точная природа и механизм этих реакций считаются еще не до конца выясненными [20]. В кислых средах преобладает реакция (1) при известной доле протекания реакций (2) и (3),. в щелочных и нейтральных наиболее вероятна (5) при параллельном протекании (4).
Анодный процесс осложняется пленкообразованием. Растворение подложки идет через поры или за счет непрерывного растворения и нового формирования пленок из сульфидов FenS: для троилита n=1, пирротита 0,8 <n<1,0, а пирит и марказит— это дисульфиды с n= 2. Эти последние образуются при повышенных активностях HS- и S2-, т. е. в основных сероводородных средах.
По [20] для сложного и не совсем ясного механизма пленкообразования при анодном процессе предложено два пути формирования FeS:
растворение с осаждением
![]()
непосредственно пленкообразование
![]()
Eстац железа в сульфидных растворах при 4 < pH < 12 составляет от —0,38 до +0,60 В. Сопоставление с диаграммой Пурбэ предопределяет в таких средах существование FeS2. Однако лишь в узкой области pH =14 в 1 н: Na2S отмечено отвечающее термодинамике образование FeS2; при pH < 14 во всей области установлено существование FeS.
Ускорение катодного процесса связано с адсорбцией HS-- ионов [11]. Они могут ускорять разряд Н+-ионов за счет возникновения адсорбционного Fi-потенциала отрицательного знака HS--ион не меняют дифференциальную емкость железа и снижают водородное перенапряжение nh. С другой стороны, они снижают энергию связи водорода с металлом за счет образования прямой связи Me—HS-. Однако достигаемое увеличение скорости катодного процесса за счет уменьшения nh и возникновения отрицательного Fi превалирует над возникающим в присутствии HS- ослаблением связи водорода с металлом.