Адсорбция сульфидов в условиях ЭСК
С помощью радиоактивного изотопа 35S показана избирательность адсорбции на кристаллических поверхностях разной ориентации: адсорбция серы максимальна на гранях кристаллов Fe с ориентацией (111) и минимальна — при (110). Адсорбции S из газовой среды препятствует конкурентная адсорбция О. Физическая адсорбция переходит в хемосорбцию с образованием прочно сцепленного слоя серосодержащего соединения [9]. Серодейтерий D2S адсорбируется сильнее, чем сероводород [10].
В водных растворах сульфидов происходит конкурентное вытеснение ОН--ионов ионами HS- на поверхности металла. Сильная адсорбция HS- ионов сопровождается сегрегацией серы на поверхности или на границах зерен [14]. Сера самопроизвольно диффундирует в железо и сталь на глубину до 120 мкм (при 500 °С) нормально к поверхности [6].
Адсорбция HS- влияет на протекание коррозионных процессов. Возникновение адсорбционного потенциала отрицательного знака стимулирует разряд Н+ -ионов и ускоряет катодный процесс. Однако возможно и замедление разряда за счет снижения энергии связи водорода с металлом. Ионы HS- не снижают емкости двойного слоя, но понижают водородное перенапряжение. С участием H2S предполагается образование на поверхности соединений ионного и дипольного характера [11].
Хемосорбционные частицы HS- снижают энергию внедрения водорода в железо [12]. Подкисление препятствует адсорбции HS- - ионов и сопутствующим эффектам: возможна десорбция этих ионов за счет ассоциации HS- + H+ → H2S. Десорбции HS- должна способствовать катодная поляризация [12].
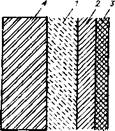
Рис. 4 2. Формирование пленок сульфида железа при погружении малоуглеродистой стали в дистиллированную воду, насыщенную сероводородом [15]:
1 — начальный слой из соединения Fe9S8 (канзита); 2— второй слой из соединения Fe7S8 (пирротина); 3—третий слой из соединения FеS2 (пирита); 4—поверхность металла.
Адсорбция HS- ионов не только стимулирует ЭСК (за счет формирования с железом комплексных соединений), но и облегчает наводороживавие за счет ослабления связи между атомами металла [11—13].