Кинетика димеризации изобутилена
Исследования кинетики димеризации изобутилена в присутствии ортофосфорной кислоты показали [191, с. 491—498], что при низких парциальных давлениях изобутилена скорость реакции имеет по нему второй порядок. При повышении давления кинетическое уравнение становится более сложным:
![]()
Зависимости констант а и Л от температуры передаются следующими выражениями: α = 26,5 ехр( 13500/RT); А = 37,5ехр(—20700/RT).
При 90°С и давлении более 1,8 МПа скорость реакции практически перестает зависеть от давления. При 150°С скорость реакции не зависит от давления при давлении более 14 МПа.
Полимеризация пропилена в широком диапазоне варьирования условий реакции описывается простым уравнением второго порядка по пропилену.
Зависимость константы скорости реакции от температуры, определенная для катализаторов жидкая фосфорная кислота [192, с. ПО] и фосфорная кислота на кварцевом щебне [193], оказалась примерно одинаковой при совпадении концентрации кислоты; с повышением температуры на 55 °С скорость реакции возрастает вдвое, что соответствует энергии активации 21 кДж/моль.
В результате исследования кинетики полимеризации пропилена под действием разбавленной фосфорной кислоты при 260—305 °С и давлении 27,0—40,0 МПа были сделаны выводы, что механизм этого процесса можно представить следующими реакциями [194]:
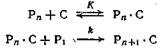
где Рn — полимер и мономер (при n = 1), С — катализатор (Н3РО4), РnC — комплекс катализатор — полимер.
При описании этой схемы автор [194] сделал предположение, что активный комплекс представляет собой сложный протонированный эфир фосфорной кислоты, имеющий структуру
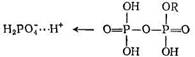
или
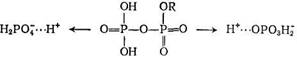
и что первая стадия его образования является равновесной, а вторая медленной.
В таком случае скорость образования молекул полимера опишется уравнением:
![]()
Поскольку в условиях экспериментов практически весь продукт находится в газовой фазе, то было принято, что
![]()
где P0 — общее число молей в системе; ∑ — общее число молей полимера в системе.
Совместное решение этих уравнений приводит к следующему выражению [194]:
![]()
Для распределения продуктов по степени полимеризации получено выражение:
![]()
где п — степень полимеризации.
Рассмотрение кинетических данных обнаружило некоторое несоответствие между вычисленными и экспериментальными значениями парциального давления компонентов газа, однако все-таки позволило автору [194] сделать однозначный вывод о том, что промежуточные соединения Рn∙С можно рассматривать только как эфиры или ионные пары (карбкатион — кислый фосфатный противоион). Предположение о промежуточном образовании свободных, т. е. неассоциированных карбкатионов ионов представляется маловероятным [194].