Особенности синтеза в газовой фазе
При разработке процессов синтеза углеводородов в газовой фазе на стационарных катализаторах особое внимание уделяли эффективному отводу реакционного тепла (≈2540 кДж на 1 м3 превращенной смеси СО + H2) при возможно более полном превращении используемых оксида углерода и водорода. При переходе от лабораторных и опытных исследований к промышленным и к созданию высокопроизводительного синтеза выявились отличительные особенности газофазного способа на стационарных катализаторах.
При использовании кобальтовых или железных катализаторов в стационарном слое в интервале 0,1—2,5 МПа рабочие температуры лежат в области 180—260°С. Более совершенные и надежные расчеты термодинамического равновесия исходных и конечных продуктов [8, с. 229; 114] подтвердили, что при названных условиях образование углеводородов, более тяжелых, чем метан, вероятно только в незначительной степени. Следовательно, состав образующейся смеси углеводородов определяется кинетикой гидрирования оксида углерода и свойствами катализатора и реакционной системы, а термодинамические факторы (состав и давление синтез-газа) при данных температурах не имеют существенного значения.
Механизм синтеза углеводородов из СО и Н2 (см. стр. 285), который пока еще однозначно не выяснен, предполагает наличие большого числа взаимосвязанных первичных и последующих ступеней [31, 44]. Множество образующихся продуктов и то обстоятельство, что в ФТ-синтезе не устанавливается термодинамическое равновесие, приводили к тому, что описание кинетики ограничивалось формальным подходом, а полученные уравнения описывали скорость суммарной реакции в упрощенном виде [115].
Адсорбционные измерения на стационарных катализаторах в газовой фазе, когда транспортирование вещества в макроскопической области имеет подчиненное значение, позволили установить, что оксид углерода хемосорбируется на катализаторе значительно прочнее, чем водород. Поэтому практически при всех давлениях, обычных для синтеза, степень покрытия поверхности катализатора оксидом углерода одинакова. Ступенью, определяющей скорость суммарной реакции, является адсорбция (или хемосорбция) водорода и его реакция с хемосорбированным оксидом углерода. Измерения при различных парциальных давлениях оксида углерода или водорода и постоянных других условиях показали, что скорость реакции при синтезе в газовой фазе не зависит от парциального давления СО и подчиняется уравнению первого порядка по водороду [116]. Данные по точному распределению продуктов при изменении времени контакта показали, что вода образуется в качестве первичного продукта и может далее по реакции водяного газа превращаться на железных катализаторах в СО2 и Н2. Скорость превращения оксида углерода на кобальтовых катализаторах может быть формально описана уравнением
в то время как на железных катализаторах тормозящее влияние продуктов последующей реакции (вода и диоксид углерода; оба сильно адсорбируются) выражено более сильно и его нужно дополнительно учитывать [103, 117]:
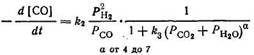
Эти уравнения воплощают формальный подход к оценке скорости суммарной реакции, но особенно второе уравнение после подбора коэффициента а позволяет описать систему катализатор — реактор и бывает весьма ценным при сопоставительной оценке или масштабировании. Однако других заключений, вытекающих из этого уравнения (например, в отношении механизма реакции Фишера — Тропша), на основании такого формального подхода делать не следует.
Реакция Фишера—Тропша может сильно тормозиться в присутствии диоксида углерода и особенно воды (рис. 126) [103, 117]. Поэтому для возможно более полного превращения смеси СО + Н2 принципиально возможны два пути:
- при подаче газа, обогащенного водородом, разбавлять свежий газ относительно большим количеством циркулирующего газа, из которого вода (и продукт реакции) выделены конденсацией;
- при подаче газа, обогащенного оксидом углерода, образующуюся воду необходимо как можно полнее расходовать на конверсию СО, хотя при этом приходится мириться с тем, что выделяющийся диоксид углерода тормозит реакцию.
Оба направления можно реализовать с приблизительно одинаковым результатом, поэтому при синтезе в газовой фазе на стационарном катализаторе применяют исходный газ, обогащенный и водородом и оксидом углерода (отношение СО : Н2 от 1 : 2 до 1 : 0,7), и обеспечивают [118] примерно постоянное превращение реагентов по высоте реактора и оптимальное использование катализатора. В пользу газа, обогащенного водородом, говорят более высокая надежность процесса, снижение степени разложения оксида углерода на высокоактивных катализаторах, положительное влияние более высокого парциального давления водорода на скорость реакции подавление экзотермической конверсии СО.
Влияние транспортирования вещества, как лимитирующей составляющей скорости суммарной реакции,
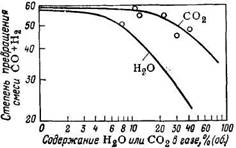
Рис. 126. Влияние добавок Н2О и и СО2 на степень превращения исходного газа на стационарном слое железного катализатора в газовой фазе [118].
в двухфазной системе (газовая фаза — катализатор) проявляется весьма мало. Однако транспортирование вещества имеет значение для фазовых превращений в граничной пленке на поверхности катализатора, которые, в свою очередь, зависят от заданных свойств реагентов и образующихся продуктов, а также от свойств катализатора, воздействие которых не всегда можно предсказать. Общеизвестные вопросы перехода вещества через граничную поверхность и градиенты концентрации, которые появляются при этом из-за неодинаковой растворимости или диффузионной способности, как и при других газофазных процессах катализа, практически не учитываются. Это облегчает построение моделей (формальных) реакции указанного типа.
При техническом осуществлении синтеза Фишера — Тропша на стационарных катализаторах вначале выявились отдельные трудности, которые не возникали при других технически опробованных каталитических процессах превращения газов.
Например, выделяющееся тепло отводили от катализатора к внутренней охлаждаемой стенке, чтобы температура в зоне реакции поддерживалась в узкой области. При этом следовало исключить местные перегревы катализатора, чтобы снизить метанообразование и особенно чтобы избежать отложений углерода, иногда образующихся при пуске установки со свежезагруженным катализатором и обусловливающих перепад давления в реакторе.
Разгрузка реактора с зауглероженным катализатором представляла трудности и требовала много времени. Так как при синтезе образуются самые разные углеводороды (от метана до высокоплавких парафинов), при атмосферном давлении катализатор покрывался парафином. Его активность падала, и через относительно короткое время требовалось повторное вымывание парафина с катализатора в реакторе. Чтобы предотвратить это явление, необходимо исследовать многие варианты синтеза и осуществлять его в иных условиях, чем в трубчатом реакторе со стационарным слоем.
Была также изучена возможность отвода тепла при использо-вании стационарного или движущегося катализатора, с рециркулирующими газами или жидкостями и при осуществлении синтеза в газовой или жидкой фазах с порошкообразным (или зернистым) катализатором [122]. Правда, вместо проблем, возникающих в трубчатом реакторе со стационарным слоем катализатора, появились другие трудности и ограничения, например в отношении износа катализатора, качества продуктов, производительности реактора и т. д.