Физико-химические основы процесса газификации
Газификация твердых топлив может быть охарактеризована как совокупность гетерогенных и гомогенных реакций; из них в конечном счете желательны те, которые приводят (в зависимости от цели процесса) к образованию СО, Н2 и СН4 в качестве составных частей газа. Газообразные смеси СО + Н2 с разным соотношением компонентов необходимы для многих синтезов. Непосредственное образование метана имеет большое значение для производства газа SNG.
Для некоторых реакций можно не учитывать наличие в топливе и газифицирующем агенте небольших количеств неосновных составляющих (азот, сера, инертные газы). Если допустить, что твердое топливо состоит только из углерода, будут справедливы следующие уравнения:

Этими уравнениями с достаточной полнотой описываются гете-рогенные реакции образования желаемых газообразных соединений. Одновременно учитывается, что первичные продукты газификации, например СО2, могут в дальнейшем взаимодействовать с углеродом, еще находящимся в реакционном объеме. Однако при этом не принимается во внимание, что из твердого топлива также получаются продукты его термического разложения: диоксид углерода, вода, водород и продукты полукоксования (углеводороды), которые могут взаимодействовать с раскаленным углеродом. Совместно с гомогенными превращениями первоначально образовавшихся газов
![]()
процессы в газогенераторе описываются уравнениями (1) — (6) с достаточной полнотой. Приведенные уравнения не учитывают образования углеводородов С2 и выше. Однако это ограничение обоснованно, потому что реакции газификации протекают со скоростью, достаточной для технических целей, только при таких высоких температурах, когда образование высших углеводородов практически исключается.
Для гомогенных газовых реакций (5) и (6) справедливы следующие равновесные соотношения:

В качестве примера гетерогенных реакций можно выбрать реакцию Будуара (2), причем при теоретическом рассмотрении допустимо принять, что углерод испаряется и участвует в реакциях в газообразном состоянии. Для этого случая константу равновесия гомогенной реакции (2) можно представить так:
![]()
При избытке углерода, а это всегда имеется при газификации угля, парциальное давление паров углеводорода практически зависит только от температуры, так что его можно объединить с тоже зависимой от температуры константой равновесия (K2 = К2*Рс), и уравнение (9) примет вид:
![]()
Аналогичные соображения справедливы и для других гетерогенных реакций. В табл. 18 приведены константы равновесия важнейших реакций газификации топлив.
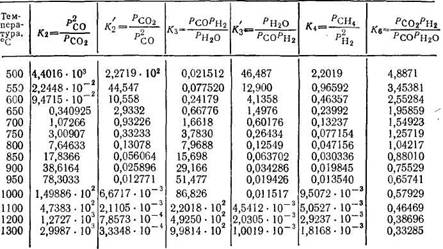
Примечание. К* означает константы равновесия обратных реакций
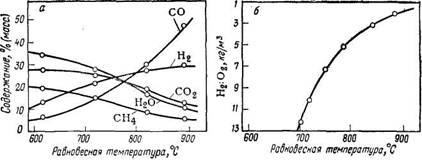
Рис. 55. Зависимость состава газа, получаемого при газификации при «2 МПа (а) и состава газифицирующего агента (б) от равновесной температуры.
Гомогенные и гетерогенные реакции протекают при существенном изменении энергии системы, поэтому в табл. 19 даны энтальпия и константы равновесия самых важных реакций, протекающих при горении и газификации топлив.
С помощью термодинамических функций можно рассчитать равновесный состав газов газификации в зависимости от температуры, а также температуру, при которой достигается равновесие, в зависимости от состава газифицирующего агента. Результаты расчетов представлены на рис. 55. Пользуясь этими графиками, можно установить для каждой смеси Н2О + О2 (газифицирующий агент) температуру и состав газа, образующегося при газификации в условиях равновесия с углеродом. Аналогичные графики можно рассчитать для любого давления. Однако они имеют только теоретическое значение, так как ни расчетные составы газов, ни соответствующие им расходные показатели в условиях реальной газификации практически не достигаются, прежде всего потому, что метан образуется в значительно меньшем количестве, чем теоретически возможно. Выход метана (м3 на 1 т угля или % в газе) в значительной степени зависит от типа газифицируемого топлива. Термодинамика, естественно, не может дать указаний, через сколько времени и каким путем устанавливается равновесие. Это — задачи кинетики.
Конечно, однозначно определить степень превращения вещества угля весьма сложно; для этого нужно учитывать очень много параметров. Среди них, например, условия процесса (в основном давление, температура, состав газифицирующего агента, время контакта между газом и топливом), структура пор твердого топлива, его элементный состав и многое другое. Кроме того, большое значение имеет скорость разложения твердого топлива при термической обработке; важно также учитывать условия подачи топлива и газифицирующего агента в газогенератор — прямотоком или противотоком.
Несмотря на интенсивные исследования в этой области, еще не разработаны общепринятые основы для расчета влияния этих параметров, их взаимное влияние может быть оценено только качественно. Три разных процесса влияют на скорость газификации:
- химическая реакция, которая в интервале 600—900 °С является лимитирующей стадией газификации;
- диффузия в порах, влияющая на скорость газификации до 1200°С;
- диффузия в граничном слое.
Производительность газогенератора зависит и от других факторов, прежде всего от технологического оформления процесса в аппарате.