Принятая для моделирования кинетическая схема риформинга
Для принятой кинетической схемы риформинга (рис. 8.1) уравнение (8.2а) трансформируется в систему уравнений, левые части которых описывают накопление или расходование каждого класса углеводородов по координате реактора, а вид правых частей определяется реакциями образования и расходования данного класса углеводородов согласно кинетической схеме. При этом расходом углеводородов на образование кокса пренебрегают, а водород рассматривается как отдельный класс углеводородов из одного представителя.
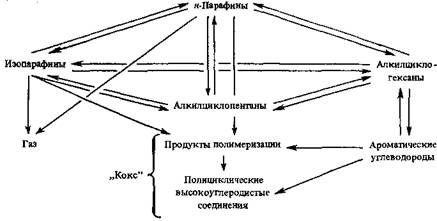
Рис. 8.1. Принятая для моделирования кинетическая схема риформинга.
При проведении конкретных численных расчетов надо раскрыть структуры уравнений системы (8.2) и иметь значения констант.
В принципе кинетика реакций процесса риформинга должна описываться уравнениями лэнгмюровского типа, однако поскольку адсорбционные коэффициенты различных углеводородов, участвующих в риформинге отдельных нефтяных фракций близки, знаменатель в указанных уравнениях существенно не меняется по ходу реакций и скорости их достаточно хорошо описываются уравнениями первого порядка по реагирующему углеводороду с эффективными константами. Парциальное давление водорода по-разному влияет на отдельные реакции, составляющие процесс риформинга. Так, его увеличение ускоряет реакцию гидрокрекинга и тормозит реакцию дегидроциклизации. Точно так же водород за счет гидрирования жидких полимеров уменьшает скорость коксоотложения. Принимается, что влияние парциального давления водорода достаточно удовлетворительно описывается степенной функцией. По данным [316] показатель в ней равен для реакции дегидроциклизации 0,6, гидрокрекинга 0,6, изомеризации н-парафинов 0.
Ход превращения смеси углеводородов можно представить как марковскую цепь. Это означает, что состояние системы в данный момент времени или, что то же, в данной точке по координате реактора полностью определяет вероятность ее состояния в следующий момент времени или следующей точке реактора. В соответствии со стохастической трактовкой кинетики химических реакций соотношение вероятностей взаимных превращений углеводородов идентично соотношению констант скорости этих превращений при равной структуре описывающих их уравнений. Тогда для решения поставленной задачи значения переходных вероятностей (вероятностей взаимных превращений углеводородов) должны описываться функцией от молекулярной массы в каждом классе углеводородов, а для машинных расчетов такая зависимость может быть дана в виде таблицы.
Таблица 8.1. Таблица переходных вероятностей разрыва С—С-связей в н-парафинах (расчетные данные)
X | X | |||||||||||
l | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
1 | 0 | 1 | 0,5 | 0,1 | 0,1 | 0,05 | 0,01 | 0,001 | 0 | 0 | 0 | 0 |
2 | 0 | 0 | 0,5 | 0,8 | 0,4 | 0,2 | 0,1 | 0,049 | 0,004 | 0,003 | 0,002 | 0,001 |
3 | 0 | 0 | 0 | 0,1 | 0,4 | 0,5 | 0,39 | 0,2 | 0,126 | 0,1 | 0,07 | 0,059 |
4 | 0 | 0 | 0 | 0 | 0,1 | 0,2 | 0,39 | 0,5 | 0,37 | 0,23 | 0,15 | 0,12 |
5 | 0 | 0 | 0 | 0 | 0 | 0,05 | 0,1 | 0,2 | 0,37 | 0,334 | 0,278 | 0,21 |
6 | 0 | 0 | 0 | 0 | 0 | 0 | 0,01 | 0,49 | 0,126 | 0,23 | 0,278 | 0,23 |
7 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0,001 | 0,004 | 0,1 | 0,15 | 0,21 |
8 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0,003 | 0,07 | 0,12 |
9 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0,002 | 0,059 |
10 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0,001 |
11 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
12 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
Таблица 8.2. Таблица переходных вероятностей разрыва С—С-связей в н-парафинах по данным [316]
X | X | |||||||||||
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
1 | 0 | 1 | 0,5 | 0,4 | 0,2 | 0,1 | 0,05 | 0,001 | 0,001 | 0,001 | 0,001 | 0,001 |
2 | 0 | 0 | 0,5 | 0,4 | 0,3 | 0,15 | 0,1 | 0,005 | 0,069 | 0,078 | 0,048 | 0,018 |
3 | 0 | 0 | 0 | 0,1 | 0,3 | 0,3 | 0,12 | 0,12 | 0,1 | 0,1 | 0,1 | 0,10 |
4 | 0 | 0 | 0 | 0 | 0,2 | 0,2 | 0,15 | 0,15 | 0,15 | 0,15 | 0,12 | 0,1 |
5 | 0 | 0 | 0 | 0 | 0 | 0,25 | 0,35 | 0,37 | 0,4 | 0,35 | 0,27 | 0,25 |
6 | 0 | 0 | 0 | 0 | 0 | 0 | 0,23 | 0,3 | 0,25 | 0,23 | 0,23 | 0,22 |
7 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0,001 | 0,029 | 0,08 | 0,15 | 0,1 |
8 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0,001 | 0,01 | 0,06 | 0,09 |
9 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0,001 | 0,01 | 0,07 |
10 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0,001 | 0,05 |
11 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0,001 |
12 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
В табл. 8.1 и 8.2 представлены значения переходных вероятностей, вычисленные на основе проведенных экспериментов, общетеоретических соображений органической химии и данных работы [316]. Существенное преимущество изложенного подхода то, что при построении кинетических моделей для конкретных катализаторов не требуется определять константы скорости реакций всех углеводородов, а только отдельных, реперных.
Для конкретных расчетов по кинетической модели с учетом дезактивации катализатора должны быть раскрыты структуры уравнений (8.26) и (8.2в).