Гидрогенизация угля. Механизм и кинетика
Для объяснения механизма непосредственной гидрогенизации угля предложена следующая схема [53]:
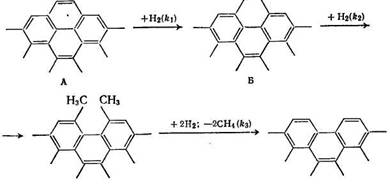
В Г
Из схемы очевидно, что доступная для реакции концевая группировка (во фрагменте А)
на поверхности угля заменяется новой подобной группой (во фрагменте Г), так что число активных центров в твердом теле остается постоянным. Принимая далее, что отщепление метана идет быстрее по сравнению с реакциями в предшествующих ступенях, протекающих в области кинетического равновесия, и что создается стационарная концентрация промежуточного продукта (фрагмент Б), можно вывести кинетическое уравнение типа уравнения Лэнгмюра — Хиншельвуда:
где с — число реакционноспособных концевых групп —СН = СН— на единицу массы угля. Уравнение (18) находится в соответствии с экспериментально установленным суммарным порядком реакции: « 2 при низком давлении, а при повышении давления порядок приближается к 1.
В производственных условиях, однако, реализуются и другие возможные механизмы, кроме того, при угаре угля изменяется и кинетика. При повышенном давлении в области насыщения поверхности адсорбируемым водородом вероятен нулевой порядок по водороду.
Определение энергии активации гидрогенизации связано с трудностями, потому что твердый реагент (уголь) с повышением температуры подвергается значительным изменениям, приводящим в конце концов к продукту, аналогичному графиту. Поэтому если расчет энергии активации вести для газификации графита [7, 8], можно получать воспроизводимые результаты (типичные результаты см. в лит. [53]). Энергия активации в экспериментах при ≈ 3 МПа растет с возрастанием «угара»: ≈ 68 кДж/моль вначале, 176,0 кДж/моль при 30%-ном «угаре» и 209,5 кДж/моль при 60%-ном «угаре». В случае спектрально чистого электродного кокса найдена [13] энергия активация, равная 358,3 кДж/моль. Совпадение ее с энергией активации реакции Будуара может оказаться случайным; предэкспоненциальный множитель при метанировании, к сожалению, в 230 раз меньше, чем при реакции Будуара.
Скорость метанирования при 871 °С и ≈ 3 МПа равна ≈ 50-10-4 моль СН4 на 1 атом С в минуту вначале и падает до ≈ 25-10-4 моль СН4 при 50%-ной степени конверсии угля.
Чтобы выяснить влияние уже образовавшегося метана на скорость реакции, добавляли метан к водороду. Эффект достаточно точно соответствовал ожидаемому из приближенных расчетов термодинамического равновесия. Это дополнительное влияние можно представить, если эффективную скорость реакции wэф выразить через скорость с чистым водородом как реагентом (w0), умноженную на выражение, которое представляет собой меру отклонения системы от равновесия:
Оказалось, что в этом случае метан проявляет себя в соответствии с законом действующих масс только при блокировании хемосорбции, но не оказывает ингибирующего влияния на реакцию.
В литературе было предложено [7] формальное выражение типа уравнения Лэнгмюра. Оно позволяет сопоставлять кинетические измерения на очень многих типах углей и показывает эмпирический характер результатов исследования.