Кинетические уравнения реакций
Для скорости ФТ-реакции на кобальтовых катализаторах [101] приводится следующее выражение
Здесь а — произведение поверхности катализатора на скорость десорбции углеводородных цепочек с этой поверхности, b — константа равновесия реакции образования цепочек.
Для железных катализаторов приводятся другие уравнения, включающие превращения и по реакциям ФТ-синтеза и по равно-весию водяного газа. На плавленых катализаторах при составе исходного газа СО : Н2 = 1 : 1 оказалось пригодным следующее выражение [102]:
![]()
где и — степень превращения в расчете на синтез-газ;
а — коэффициент;
Р — давление, ат;
G — объемная скорость, ч-1;
Е — суммарная энергия активации, равная 83,7 кДж/моль;
R — газовая постоянная; Т-— температура, К.
Для оcажденных железных катализаторов предложено иное полуэмпирическое уравнение скорости [103, 104]:
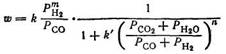
В зависимости от катализатора т меняется от 1 до 2, а л от 4 до 7. Это уравнение учитывает влияние соотношения СО: Н2 в исходном газе и вторичную реакцию водяного газа, однако представляется невероятным, чтобы член, включающий концентрации Н2О и СО2 и определяющий скорость реакции, мог возводиться в столь высокую степень (7). Экспериментальные данные в широкой области рабочих условий и для различных железных катализаторов лучше описываются другим уравнением [105]:
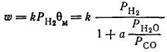
При этом принимается, что скорость прямо пропорциональна парциальному давлению водорода. Параметр 0М показывает долю железа, находящегося в активной зоне катализатора в металлическом состоянии (свободное железо, карбид или нитрид железа). В этой зоне одновременно протекают окисление железа реакционной водой и обратная реакция — восстановление оксидов железа оксидом углерода до металла.
Недавно плавленые железные катализаторы были исследованы [106] в дифференциальном реакторе со стационарным слоем катализатора при ≈240°С и 1—2 МПа. Для свежего газа состава Н2: СО = (1,2 -— 7,2): 1 при очень высоких объемных скоростях подачи сырья и малых степенях превращения найдено следующее выражение скорости:
w = kPH2
Оно эквивалентно предыдущему, так как в дифференциальном реакторе с небольшим слоем катализатора величина а(Рн,о/Рсо) очень мала.