Получение жидких продуктов из углей
Наряду с технологическими разработками для процессов деструктивной гидрогенизации важно знать, как и с какой скоростью превращаются те или иные компоненты сырья для деструктивной гидрогенизации. Такого рода исследования всегда велись параллельно с технологическими разработками.
По современным моделям химического строения угля [1, 2], его органическая масса представлена смесью высокомолекулярных полимеров нерегулярного строения. Углеродные скелеты содержат ароматизированные фрагменты, причем их доля и число ароматических колец растут со степенью метаморфизма угля. Водород, кислород, азот, сера и другие элементы могут входить в алифатические, алициклические и гетероциклические группировки. В работе [3], например, получены данные, свидетельствующие о присутствии в органической массе угля фрагментов со структурой бензола, нафталина, фенантрена, флуорантена, флуорена, антрахинона, бензантрахиноиа, нафтаценхинона, дибензофурана, бензонафтофурана, ксантона, бензоксантона и других циклических соединений ароматического характера. О сложности строения органической массы угля можно судить по тому, что из коксовой смолы, например, выделено до 500 типов соединений, включающих, кроме углерода и водорода, один, два и три атома кислорода, один и два атома азота, атомы серы в комбинации с кислородом и азотом и др. [4]. Как ароматизированные фрагменты, так и алифатические мостики между ними могут иметь различные функциональные группы — гидроксильные, эфирные, карбоксильные и др.
Гидрогенизация органического вещества угля соответственно должна включать (не рассматривая здесь процессов набухания, пептизации, растворения) реакции насыщения водородом ароматических колец, реакции разрыва и насыщения водородом гетероатомных связей (С—О, С—N, С—S) и С—С-связей, различные реакции изомеризации, а в условиях недостатка водорода и реакции полимеризации и конденсации. Обычно превращение угля в процессе деструктивной гидрогенизации представляется последовательными группами реакций, сначала превращающих уголь в асфальтены, а затем асфальтены — в масло [5]. В последнее время в качестве пастообразователя все чаще применяют продукты или фракции, легко отдающие водород. Поэтому схема уголь->-асфальтены -> масло усложняется еще процессом передачи водорода от донора и, согласно работе [6], каталитической и некаталитической передачей водорода от асфальтенов.
Процесс ожижения угля описывается в первом приближении формальными уравнениями первого порядка. Попытки учесть свойства угля, количество растворителя и другие факторы приводят к сложным эмпирическим уравнениям. Например, для процесса SRC выведено уравнение [7]:
|
где Cso — массовый процент ОМУ; x — степень превращения = % ОМУ, перешедший в раствор/%ОМУ в угле; c/S — отношение количеств угля и растворителя; РH2 — парциальное давление водорода, кгс/см2.
Определенная по этому уравнению энергия активации Е для различных углей составила 18—45 кДж/моль.
Вследствие сложности превращений изучать химизм процесса непосредственно на примере угля практически невозможно, и поэтому, уже начиная с ранних исследований в области гидрогенизации угля, химизм его превращения изучали на примерах соединений, моделирующих те или иные участки структуры угольного вещества [5].
Ниже рассмотрен основной экспериментальный материал, с тем чтобы попытаться сформулировать основные закономерности превращений веществ, моделирующих фрагменты угольного вещества, в условиях деструктивной гидрогенизации.
Скорость гидрирования ароматических колец определяется многими факторами; важнейшими среди них являются порядок связи и пространственные затруднения, создаваемые заместителями. Конденсация двух или более бензольных колец в полициклических ароматических соединениях нарушает симметрию и равенство электронной плотности связей бензольного кольца из-за того, что некоторые из них укорачиваются. В нафталине, антрацене и других многокольчатых углеводородах уже есть связи, порядок которых больше, чем в бензольном кольце, т. е. эти связи
Таблица 74. Относительная скорость гидрирования ароматических углеводородов на различных катализаторах
Скорость гидрирования нафталина принята за 100
Углеводород | PtO2, 40 С [8] | Ni Peнея. 50 °С [9] | Ni на AI2O3, |20-130°С [10] | MoS2, 375-380 С [11] | MoS2, 420 °С, [10] | ws2, 400-420 °С [10] | Fe на полукоксе, 480 °С [9] | Комплекс Rh. 50 °С [12] |
Бензол | 670 |
| 32 | _ | 7 | 4 |
| 43 |
Дифенил | 164 | 23 | 33 | — | — | — | 48 | — |
Нафталин | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
Антрацен | 124 | 338 | 104 | 300 | — | 270 | 923 | 345 |
Фенантрен | 24 | 59 | 152 | 50 | - — | — | 89 | 126 |
Тетрацен | 135 | — | — | — | — | — | — | — |
1,2-Бензантрацен | 77 | — | — | — | — | — | — | — |
Хризен | 29 | 19 | _ |
| — | 3,5 | — | 83 |
Пирен | 38 | 88 | — | — | — | — | — | 81 |
Коронен | 14 | 12 | — | — | — | — | Не гид рируется | — |
приобретают частично характер изолированной двойной связи. В табл. 74 сведены данные об относительной скорости гидрирования ароматических углеводородов.
Эти данные говорят о сложном влиянии строения ароматических углеводородов на скорость их гидрирования. Однако, как правило (особенно в условиях высокотемпературных процессов), многокольчатые углеводороды гидрируются быстрее моноциклических, а среди многокольчатых линеарные углеводороды (антрацен, тетрацен) гидрируются быстрее ангулярных и центрированных. Эта закономерность, особенно наглядно проявляющаяся при гидрировании в присутствии комплексного катализатора, т. е. в условиях, не осложненных адсорбцией и десорбцией, корреспондирует с числом укороченных связей и их порядком. Так, можно составить ряд [8. 12]:
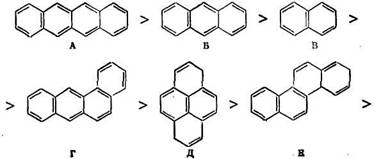
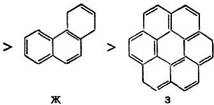
Для соединений А — 3 можно записать:
Показатели | А | Б | В | г | Д | Е | Ж | 3 |
Наибольший порядок связи | 1,746 | 1,738 | 1,725 | 1,783 | 1,682 | 1,750 | 1,775 | «1,700 |
Число таких связей | 4(2) | 4(2) | 4(2) | 1 (0,5) | 6(1) | 2(1) | 1 (0,5) | 6(1) |
Скорость гидрирования | ||||||||
на Pt | 135 | 124 | 100 | 77 | 38 | 29 | 24 | 14 |
на Rh | — | 345 | 100 | __ | 81 | 83 | 126 | _ |
Примечание. В скобках указано число укороченных связей, доступных для атаки водородом при адсорбции на платине (см. [4] и [5]).
Следует подчеркнуть, что такая закономерность зависимости начальной скорости гидрирования от числа и кратности укороченных связей в полициклических углеводородах в реальных условиях деструктивной гидрогенизации может искажаться термодинамическими или адсорбционными ограничениями (недостаток водорода на поверхности катализатора), что нужно учитывать при предвидении результатов.
Переход от карбоциклических к гетероциклическим соединениям, как правило, ускоряет гидрирование, так как введение гете-роатома в кольцо еще больше нарушает его симметрию. Например, фуран и его производные гидрируются на платине Адамса в среднем в 2,7 раза быстрее бензола и его аналогичных производных [13]. Соединения, содержащие одновременно карбо- и гетероциклические кольца (хинолин, пиррол, бензофуран), всегда гидрируются в первую очередь в гетероциклическое кольцо [5, 13].
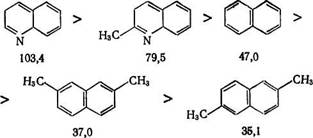
Заместители у ароматических колец, как правило, затрудняют гидрирование и тем больше, чем больше число этих заместителей. Эта закономерность, открытая еще в 30-х годах А. В. Лозовым при опытах с никелевым катализатором [11], была распространена на платиновые катализаторы [13] и наблюдается в очень многих случаях, в том числе с производными нафталина и гетероциклических соединений, например, на PtO2 константа скорости гидрирования (k40°c10-3, мин-1) равна:
При гидрировании полициклических ароматических систем гидрированные кольца ведут себя как алифатические заместители, и поэтому скорость гидрирования с глубиной гидрирования очень быстро снижается, например [8]:
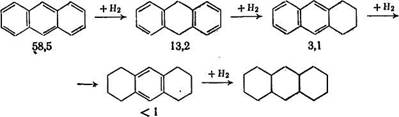
По мере насыщения полициклического соединения водородом возрастают число насыщенных связей и вероятность их разрыва, поэтому направленность изменения скоростей гидрирования и расщепления гидрированных колец диаметрально противоположны: первые падают, а вторые возрастают с глубиной гидрирования [10]. Эта закономерность подтверждается и расчетами изменения энтальпии при протекании различных типов реакций: в случае гидрирования двойной связи оно составляет 101—137 кДж/моль, для гидрирования ароматических колец 56—70 кДж/моль, для деструкции С—С связей от 29 до 69 кДж/моль, т. е. становится сравнимым с изменением энтальпии при гидрировании ароматических колец [15].
В силу этих закономерностей в продуктах высокотемпературного гидрирования полициклических ароматических систем (а именно такого рода процессы используются при ожижении угля) преобладают смешанные нафтено-ароматические углеводороды с одним, максимум с двумя нафтеновыми кольцами.
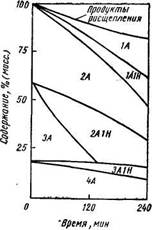
Рис. 206. Изменение группового состава гидрогенизата искусственной смеси во времени.
А — ароматическое кольцо; Н— нафтеновое кольцо; цифра-число колец.
Так, состав искусственной смеси двух-, трех- и четырехкольчатых углеводородов (нафталин, антрацен и пирен) изменялся в ходе гидрогенизации в присутствии катализатора Fe на полукоксе (480°С, ≈ 30 МПа), как это видно из рис. 206 [9]. Рисунок иллюстрирует быстрое превращение антрацена (ЗА), но медленное превращение пирена (4А), что совпадает с приведенным выше рядом; нафтено-ароматические углеводороды содержат в основном одно нафтеновое кольцо. Аналогичные зависимости были отмечены и в опытно-промышленных экспериментах, в которых методами кольцевого анализа были найдены следующие количества (% масс.) различных типов углеводородов [16].