Принципы осуществления одностадийного процесса олигомеризации
Основные принципы осуществления одностадийного процесса олигомеризации этилена в присутствии триэтилалюминия.
Как показали результаты кинетических исследований, энергия активации реакции вытеснения олефина из «растущей» молекулы Триалкилалюминия примерно на 42 кДж/моль превышает энергию активации реакции роста цепи. Поэтому при повышении температуры реакции взаимодействия этилена с триэтилалюминием, наряду с общим повышением скорости процесса, наблюдается опережающий рост скорости реакции вытеснения, что приводит к появлению в продуктах реакции, помимо высших алкилов алюминия, высших а-олефинов. При температуре 200°С время цикла рост цепи — вытеснение высших олефинов становится очень небольшим. Исходный триэтилалюминий принимает участие в большом числе таких циклов, так что процесс становится истинно каталитическим, а в продуктах реакции преобладают высшие а-олефины.
Средняя степень олигомеризации (n) в этом случае определяется соотношением скоростей реакций вытеснения высших олефинов и роста цепи (β):
![]()
Величина β зависит, в первую очередь, от температуры и давления.
Распределение олефинов по молекулярным массам при одностадийной олигомеризации описывается выражением [106] :
![]()
Такое распределение, характерное для многих процессов полимеризации, носит название распределения Флори — Шульца.
Интересно сопоставить кривые молекулярно-массового распределения олефинов, получаемых в двухстадийном и одностадийном синтезах при равной средней степени полимеризации. Такое сопоставление для случая n = 7 наглядно иллюстрируется кривыми, приведенными на рис. 15. Видно, что распределение Флори — Шульца, характерное для продуктов одностадийной олигомеризации, значительно шире распределения Пуассона, которым описывается состав α-олефинов, получаемых при двухстадийном синтезе.
Из анализа кривых распределения Флори — Шульца следует вывод, имеющий очень важное значение: в любых случаях мольная доля продукта со степенью полимеризации т + 1 будет меньше мольной доли продукта со степенью полимеризации т, т. е. отношение х(m + 1)/х(m) всегда меньше 1. Численное значение этого отношения иногда называют фактором роста.
Работ по изучению кинетики олигомеризации этилена в присутствии триэтилалюминия опубликовано немного. В работе [107] процесс изучался в диапазоне температур 100—180°С и давлении 0,1 — 1 МПа. Для обработки кинетических данных по скорости реакции роста использовалось уравнение:
![]()
Как уже отмечалось, в углеводородных растворах триэтилалюминия устанавливается равновесие между мономерной и димерной формами:
![]()
Если обозначить через с мольную долю триэтилалюминия в случае полной диссоциации димера, то мольная доля мономерного триэтилалюминия в условиях равновесия равна:
![]()
где Ка — константа равновесия реакции диссоциации триэтилалюминия.
Мольная концентрация мономерной формы триэтилалюминия определяется по формуле:
![]()
где D — мольная плотность реакционной массы.
Оценки значения константы равновесия реакции диссоциации триэтилалюминия, полученные при обработке кинетических данных в диапазоне 120—160°С, по порядку величин хорошо соответствуют результатам термохимических расчетов. Теплота диссоциации димерной формы триэтилалюминия близка к 83 кДж/моль Энергия активации реакции роста 63 кДж/моль [108].
В соответствии с представлениями о механизме реакции образования высших α-олефинов при олигомеризации этилена, можно записать:
![]()
Первый, член правой части этого уравнения представляет собой скорость образования алкильной группы триалкилалюминия со степенью полимеризации n + 1, второй — скорость ее расходования в реакции роста, а третий — скорость расходования в реакции вытеснения.
При стационарном состоянии dxn+1/dt = 0, отсюда легко получить:
![]()
Выполненная в работе [107] обработка экспериментальных данных в координатах хn/хп+1 — 1/[С2Н4] показывает, что отношение kn+1/kn близко к 1, т. е. константа скорости реакции роста действительно не зависит от длины цепи.
Процесс синтеза α-олефинов при одностадийной высокотемпературной олигомеризации этилена в присутствии триэтилалюминия всегда сопровождается побочной реакцией, приводящей к образованию несимметричных диалкилзамещенных этиленов — олефинов винилиденовой структуры. Они получаются в результате того, что в реакцию роста цепи может вступить не только этилен, но и присутствующие в системе ранее образовавшиеся высшие олефины:
![]()
Образующиеся алюминийалкилы с разветвленной цепью весьма нестабильны и разлагаются с очень высокой скоростью:
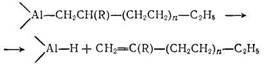
Скорость присоединения этилена по связи алюминий—углерод значительно превышает скорость достройки цепи высшими олефинами. Однако при снижении концентрации этилена и при достаточно высокой концентрации высших олефинов скорость образования олефинов винилиденовой структуры становится вполне ощутимой.
Кинетическая модель процесса олигомеризации этилена с учетом образования разветвленных олефинов разработана в работе [108]. В целом, кинетическая модель получается в этом случае весьма сложной. С учетом ряда упрощающих допущений она выглядит следующим образом:
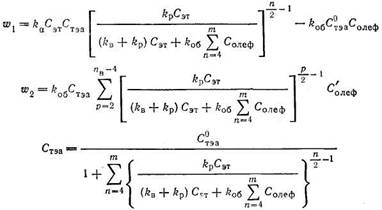
где w1 — скорость образования линейных олефинов с числом атомов n; w2 — скорость образования разветвленных олефинов с числом атомов п; Сэт — текущая концентрация этилена; Стэа — текущая концентрация триэтилалюминия; С0тэа— начальная концентрация триэтилалюминия; Солеф — текущая концентрация нормального α-олефина со степенью полимеризации n/2; Солеф — текущая концентрация разветвленного олефина со степенью полимеризации (n — р)/2; kB—константа скорости реакции вытеснения высших олефинов этиленом; kp — константа скорости реакции роста цепи; kоб — константа скорости реакции обрыва.
Энергия активации реакции роста цепи и обрыва равна 88 кДж/моль, а вытеснения— 136 кДж/моль [108].