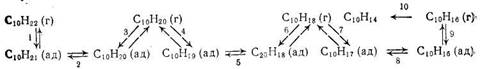Научные исследования по дегидрированию парафинов
В середине 60-х годов появились первые патенты фирмы UOP, защищающие способ дегидрирования высших нормальных парафинов в среде водорода, а в конце 60-х годов было пущено первое промышленное производство высших линейных олефинов по этому методу.
ТАБЛИЦА 13. Равновесная степень превращения нормальных парафинов в реакции CnH2n+2 <--> СПН2n + Н2 в присутствии водорода, в % [7]
Мольное отношение Н2/CnH2n+2 | Давление, МП а | Температура, °С | ||||
400 | 440 | 460 | 480 | 500 | ||
n= 12 | ||||||
1 | 0,1 | 8 | 21 | 31 | 42 | 54 |
0,2 | 4 | 12 | 19 | 28 | 38 | |
0,4 | 2 | 7 | 8 | 13 | 20 | |
8 | 0,1 | 5 | 14 | 22 | 32 | 44 |
0,2 | 2 | 8 | 12 | 19 | 28 | |
0.4 | 1 | 4 | 7 | И | 16 | |
n = 16 | ||||||
1 | 0,1 | 11 | 27 | 38 | 50 | 62 |
0,2 | 6 | 16 | 25 | 35 | 46 | |
0,4 | 3 | 9 | 12 | 18 | 26 | |
8 | 0,1 | 7 | 19 | 29 | 41 | 53 |
0,2 | 3 | 11 | 17 | 26 | 36 | |
0,4 | 2 | 6 | 9 | 15 | 22 | |
Проведение реакции дегидрирования в среде водорода ставит ее в термодинамически невыгодные условия (табл. 13). При мольном отношении Н2/CnH2n+2 = 8/1 и 0,2 МПа равновесная степень превращения нормального додекана в температурном интервале 450—500 °С, рекомендуемом для проведения процесса, не превышает 30%, а нормального гексадекана — 40%. Однако в то же время в присутствии водорода образование диенов затормаживается в большой степени, чем моноолефинов, что обеспечивает повышение селективности. Кроме того, катализаторы дегидрирования в присутствий водорода работают более стабильно, не требуя регенерации несколько сотен часов. Считается, что в атмосфере водорода гидрируются высоконепредельные соединения, из которых образуется кокс.
Основным компонентом, обеспечивающим высокую активность и селективность катализаторов дегидрирования высших нормальных парафинов, предложенных фирмой UOP, является платина.
Анализ патентов фирмы UOP [90] показывает, что вместо платины можно использовать иридий и рений. Возможно, что такие катализаторы более стабильны. Относительно невысокая стабильность платиновых катализаторов в значительной степени объясняется миграцией платины по поверхности носителя с образованием 'массивных блоков, что снижает число активных центров.
Добавки некоторых переходных металлов, обладающих сродством как к поверхности носителя, так и к платине, уменьшают подвижность последней. Такую роль играют добавки молибдена, вольфрама, рения, олова [91].
В платиновые катализаторы добавляют также элементы IVa и Va подгрупп периодической системы. Их роль заключается, по-видимому, в селективном отравлении центров, ответственных за гидрогенолиз парафинов и конденсацию непредельных соединений, ведущую к образованию смолистых соединений и кокса.
В качестве носителя для катализаторов дегидрирования высших нормальных парафинов наиболее часто используется окись алюминия. Однако описано также использование в качестве носителей цеолитов и силикагеля. В частности, в одном из патентов Французского института нефти (пат. Франции 1557900) защищен платиноиридиевый катализатор на силикагеле, работающий с селективностью 92 % при степени превращения нормальных парафинов 20 %. Хорошие результаты при использовании силикагеля были получены и в работе [91].
Выбор того или иного носителя для катализатора дегидрирования нормальных парафинов обусловлен необходимостью снизить до минимума число кислотных центров, ведущих реакции, протекающие по карбкатионному механизму — крекинг, скелетную изомеризацию. Очевидно, с этой целью в состав катализаторов вводят ионы щелочных металлов.
Исследованием влияния добавок лития на кислотные и каталитические свойства алюмоплатиновых катализаторов установлено, что малые добавки лития (0,1 %) уменьшают число кислотных центров слабой и средней силы, а большие ( 1 %) — число сильнокислотных центров [92]. Введение даже небольших добавок лития снижает общую активность катализатора, однако при постоянной степени превращения нормальных парафинов увеличение концентрации лития в катализаторе до 1 % обеспечивает повышение селективности реакции. Дальнейший рост концентрации лития приводит к спаду селективности. Практически не влияя на относительный выход диолефинов, добавки лития способствуют уменьшению образования ароматических углеводородов, продуктов крекинга и изомеризации. Ответственными за образование последних считаются кислотные центры слабой и средней силы.
Проведение реакции дегидрирования высших нормальных парафинов в среде водорода (под давлением до 0,4 МПа) приводит к улучшению показателей работы не только алюмоплатиновых, но и алюмохромовых катализаторов [93—95]. При этом увеличивается как селективность реакции, так стабильность работы катализаторов.
Интересно действие добавок щелочных металлов на изменение каталитических свойств алюмохромовых катализаторов. В отсутствие водорода добавки калия повышают активность катализатора и снижают его селективность. При парциальном давлении водорода 0,1 МПа селективность работы алюмохромовых и алюмохромкалиевых катализаторов становится одинаковой, а при давлении 0,4 МПа добавки калия и лития повышают селективность алюмохромовых контактов. И, все же, по селективности дегидрирования нормальных парафинов, в сопоставимых условиях, алюмохромовые катализаторы уступают алюмоплатиновым.
Как видно, катализаторы, применяемые для дегидрирования высших нормальных парафинов представляют собой весьма сложные системы. На наиболее эффективных катализаторах процесс дегидрирования протекает, в зависимости от условий, с селективностью 85—95 % при степени превращения нормальных парафинов до 20 %. Главными побочными продуктами реакции являются диолефины и ароматические углеводороды. Наблюдается также незначительное образование продуктов крекинга, скелетной изомеризации и уплотнения.
Механизм образования побочных продуктов при дегидрировании высших нормальных парафинов длительное время считался спорным. В настоящее время считается доказанным, что ароматические углеводороды, являющиеся конечными продуктами дегидрирования нормальных парафинов, образуются по последовательной схеме из олефинов через диолефины. Эта схема справедливjrа как для случая дегидрирования высших нормальных парафинов на алюмохромовых катализаторах [96], так и на алюмоплатиновых [97].
На основании результатов, полученных при изучении изотопного обмена водорода с дейтерием в нормальном декане и других продуктах, а также измерений величины изотопного кинетического эффекта при дегидрировании нормального декана и гидрирования нормального децена на алюмоплатиновом катализаторе с добавками вольфрама и лития, пришли к однозначному выводу, что образования ароматических углеводородов непосредственно из нормальных парафинов, минуя стадии промежуточного образования олефинов и диолефинов, не происходит [99].
Согласно [97, 98], процесс дегидрирования нормальных парафинов протекает по следующей схеме (г)—молекула в газообразном состоянии, (ад) —в адсорбированном:
|
Согласно этой схеме, последовательное превращение парафинов в олефины, ди- и триолефпны происходит с медленной десорбцией олефинов и диолефинов и повторной их адсорбцией в другой форме. Образование ароматических углеводородов из триолефинов протекает в газовой фазе без участия катализатора. Полученные экспериментальные данные можно трактовать как следствие осуществления реакций образования, олефинов, диолефинов и ароматических углеводородов на разных активных центрах. Однако такая возможность для платиновых катализаторов представляется маловероятной.
Подробное изучение кинетики процесса [99] подтвердило правильность предложенного механизма реакции. Исследования были выполнены на проточно-циркуляционной установке с варьированием парциальных давлений нормального декана, нормальных деценов и п-диэтилбензола в интервале 0,7—15 кПа, а водорода в интервале 10—100 кПа. Объемную скорость варьировали в диапазоне 200—20000 ч-1, температуру — в пределах 420—470°С. Полученные экспериментальные данные позволили окончательно установить, что процесс дегидрирования протекает по последовательной схеме.
Система кинетических уравнений, описывающих всю совокупность реакций, протекающих при дегидрировании нормальных парафинов на платиновых катализаторах, выглядит следующим образом:
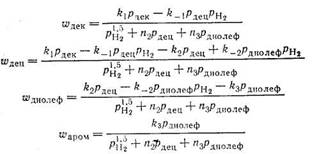
Зависимость констант (k, в моль-МПа0,5г-1г-1, n в МПа0,5) входящих в уравнения, от температуры описывается следующими выражениями [99]:
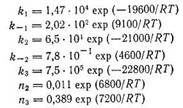
Дегидрирование нормальных парафинов протекает по следующей схеме:
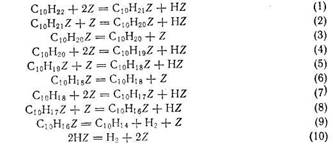
где Z — активное место поверхности катализатора.
Стадии (3), (6) и (9)— медленные. В стадии (1) происходит диссоциативная адсорбция парафина с отщеплением одного атома водорода. В стадии (2) отщепляется второй атом водорода, после чего в стадии (3) происходит десорбция олефина. В стадии (4) олефин вновь адсорбируется, но в другой форме, превращаясь в диен в стадиях (5) и (6).
Идентично происходит дегидрирование диена до ароматического соединения. На поверхности присутствуют диссоциативно адсорбированный водород, адсорбированные диен и триен, а концентрации других продуктов на поверхности пренебрежимо малы. Анализ приведенной стадийной схемы методом стационарных концентраций приводит к кинетическим уравнениям, совпадающим по форме с представленными выше, что является необходимым условием ее достоверности.