Корреляция между кислотностью и активностью оксида алюминия
Корреляция в реакциях дегидратации и изомеризации показана в ряде работ. В частности, в работе [141 ] с помощью ИК-спектроскопии подтверждено, что значительно более высокая изомеризующая активность η-оксида алюминия по сравнению с уоксидом связана с его более высокой кислотностью и что сила кислотных центров увеличивается при хлорировании оксида алюминия.
Введение хлора в гидратированную поверхность оксида алюминия, например при обработке НСl, можно схематически представить следующим образом [54]:
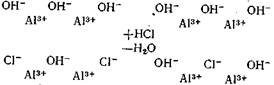
Хлор замещает часть гидроксильных групп поверхности и катион алюминия оказывается связанным с двумя различными анионами. Появление соседних ионов хлора нарушает электронную симметрию и вызывает отток электронов от связи О—Н. Благодаря этому увеличивается подвижность водорода соответствующей гидроксильной группы, т.е. повышается ее кислотность.
Существует несколько адсорбционных методов определения числа и силы кислотных центров. Наиболее рационален из них метод термодесорбции аммиака, удобный тем, что малые молекулы аммиака способны проникать в самые тонкие поры, недоступные другим адсорбатам. Сочетание адсорбции аммиака с изучением ИК-спектров позволило установить наличие на прокаленном при высокой температуре оксиде алюминия пяти видов кислотных центров [150].
Пери [144] первым предложил модель строения дегидроксилированной поверхности γ-оксида алюминия и механизм образования кислотных центров различной силы. Он принял, что поверхность γ-оксида алюминия представлена только одной кристаллографической плоскостью (ПО). При прокаливании с этой плоскости удаляются в виде воды сначала парные гидроксилы, при этом кристаллическая решетка не изменяется. Оставшиеся группы ОН покрывают только 10% поверхности. Для их удаления требуется дальнейшее повышение температуры, облегчающее миграцию анионов и катионов. На этой стадии дегидратации возрастает число нарушений кристаллической решетки, приводящих к возникновению двойных или тройных кислородных дефектов. Высказываются мнения, что именно эти высокотемпературные дефектные структуры могут являться наиболее сильными кислыми центрами.
Модель Пери очень помогла исследователям в понимании природы кислых центров оксида алюминия, но не дала возможности точно сформулировать причину разности в кислотности и активности у- и η -оксидов.
Предполагается, что поверхность η-оксида алюминия, образованная плоскостями (111), содержит большее число кислотных центров, чем поверхность γ-оксида. Считается также, что поскольку кислородная решетка в η-оксиде алюминия более рыхлая (расстояние Al—О в γ-оксиде равно 0,1811—0,1812 нм, а в η-оксиде 0,1838— 0,1826 нм) и ион алюминия занимает большее число октаэдрических позиций, эти обстоятельства должны повышать доступность активных участков поверхности.
Более совершённая модель поверхности оксида алюминля была предложена в работе [126]. Модель основана на положении, что на поверхности всех (видов) сортов оксида алюминия представлены три кристаллические плоскости шпинели (111), (110) и (100). Относительное наличие этих плоскостей должно меняться для различных сортов оксида алюминия, вместе с этим изменяется число и вид гидроксильных ионов на поверхности. Рассчитано, что в слоях ионов, образующих эти плоскости, располагаются пять типов гидроксигрупп, свойства которых определяются их координационным числом и зарядом. Взаимодействие этих гидроксилов друг с другом и с соседними группами атомов приводит к созданию высокозарядных дефектных центров. Возможно образование при этом донорно-акцепторных комплексов, имеющих характер кислотно-основного центра и обладающих повышенной каталитической активностью.