Селективность и механизм реакции дегидрирование шестичленных нафтенов
Селективность. Дегидрирование шестичленных нафтенов в ароматические углеводороды на бифункциональных платиновых катализаторах может сопровождаться другими реакциями, в частности изомеризацией в пятичленные нафтены и гидрогенолизом. Однако скорости дегидрирования шестичленных нафтенов в условиях каталитического риформинга намного больше скоростей протекания других реакций. Следствием является близкая к 100% селективность ароматизации шестичленных нафтенов [19—21].
Механизм реакции. Реакции дегидрирования циклогексана и его гомологов, приводящие к образованию ароматических углеводородов, протекают на металлическом компоненте катализатора риформинга. Адсорбция циклогексана на металлических участках катализатора может сопровождаться либо одновременной диссоциацией шести атомов водорода [22], либо последовательным быстрым их отщеплением [23].
Механизм реакции дегидрирования циклогексана [23] включает последовательное отщепление двух атомов водорода с образованием адсорбированного циклогексена. Предполагается, что эта стадия реакции—лимитирующая. Далее происходит отщепление одного за другим остальных четырех атомов водорода, в результате чего образуется бензол. Подобные представления о стадийном протекании реакции были ранее высказаны и другими авторами [24 ].
Все стадии реакции дегидрирования циклогексана на алюмоплатиновых катализаторах протекают быстро, а потому трудно обнаружить в газовой фазе циклогексен и циклогексадиен, а тем более доказать, что они являются промежуточными продуктами реакции. Существенный шаг в этом направлении был сделан в работе [25], авторы которой решили выяснить, как протекает реакция дегидрирования циклогексана на алюмоплатиновом катализаторе в условиях, близких к применяемым в каталитическом риформинге (520 °С, 2 МПа, молярное отношение водород : углеводород = 6:1). Чтобы обнаружить промежуточные продукты реакции, была поставлена, серия опытов, в которых степень превращения циклогексана изменялась в пределах от 32,0 до 2,9% увеличением объемной скорости подачи углеводорода от 1000 до 18 000 ч-1. Продукты реакции при малых степенях превращения циклогексана, наряду с бензолом, содержали заметные количества циклогексена. По мере уменьшения степени превращения циклогексана молярное отношение циклогексен : бензол значительно возрастало:
Степень превращения циклогексана, % | 32,0 | 27,5 | 18,1 | 9,1 | 5,5 | 2,9 |
(ЦГе : Б)∙103 | 1 | 7 | 17 | 24 | 28 | 29 |
Исходя из полученных результатов сделан вывод о том, что дегидрирование циклогексана в бензол протекает через промежуточную стадию образования циклогексена:
![]()
Отношение циклогексен : бензол значительно возрастает при частичной дезактивации алюмоплатинового катализатора в результате отравления серой [25]. Такой эффект, вероятно, объясняется тем, что при отравлении катализатора серой скорость дегидрирования циклогексана в циклогексен снижается значительно меньше, чем скорость дегидрирования циклогексена в бензол.
Механизм реакции раскрывают также данные, полученные при дегидрировании циклогексана под атмосферным давлением на алюмоплатиновых катализаторах, модифицированных оловом [26, 27]. При введении в алюмоплатиновый катализатор от 2,2 до 4,2% (по массе) олова значительно снижается скорость образования бензола. Продукты реакции, наряду с бензолом, содержат циклогексен и крайне незначительные количества циклогексадиена. По-видимому, как и при отравлении алюмоплатинового катализатора серой, под влиянием олова изменяются относительные скорости отдельных стадий реакции, что позволяет выявить стадийный механизм реакции дегидрирования циклогексана:
![]()
Алкилциклогексаны с блокированными положениями, благодаря наличию в них четвертичного атома углерода (гем-диалкилы), подвергаются дегидрированию на платиновых катализаторах при более высоких температурах, при которых ароматизация сопровождается перегруппировками [23]. Так, при дегидрировании 1,1-диметилциклогексана и подобных ему соединений происходит элиминирование метильной группы, в результате чего образуются толуол и метан:
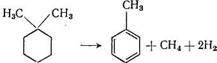
С другой стороны, происходит миграция метильных групп, что приводит к образованию изомеров ксилола:
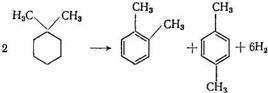
При осуществлении реакции на бифункциональном платиновом катализаторе 1,1-диметилциклогексан вероятно сперва подвергается изомеризации, после чего соответствующие изомеры диметилциклогексана превращаются в ксилолы.